P3 3-4/2022 de
Fraunhofer IAP
Forschung & Entwicklung
Enzyme als Additive in der Kunststoffverarbeitung
Die Integration von biologischen Funktionalitäten in Materialien geht über das schlichte „Lernen von der Natur“ hinaus und verfolgt das Ziel, funktionale Bausteine der Natur direkt in Kunststoffe einzubauen – unter Erhalt ihrer Funktionalität. Hierzu müssen die bestehenden Verarbeitungsmethoden derart angepasst werden, dass die Verarbeitung von polymeren Werkstoffen auch bei niedrigeren Temperaturen möglich ist, um zu gewährleisten, dass die temperaturempfindlichen Biobausteine ihre Struktur behalten und somit auch deren Funktion nach der Verarbeitung erhalten bleibt. Gleichzeitig müssen Strategien zur Stabilisierung von labilen Biomolekülen wie Enzymen entwickelt werden, die sich auch in technischen Maßstäben umsetzen lassen.
Abb. 1: Doppelschneckenextruder im Technikum des Fraunhofer IAP.
Enzyme als Additive in der Kunststoffverarbeitung
Die Funktionalisierung von thermoplastischen Kunststoffen mit Enzymen unter Erhalt der Aktivität ist ein Beispiel für eine direkte Biofunktionsintegration, insbesondere wenn die Enzyme als Additiv während der Verarbeitung zugeführt werden können. Kunststoffe werden jedoch in der Regel bei deutlich über einhundert Grad Celsius verarbeitet, Enzyme dagegen halten diesen hohen Temperaturen üblicherweise nicht stand, sodass geeignete Stabilisierungsmethoden entwickelt werden müssen. Durch die Additivierung mit Enzymen können selbst-reinigende oder sogar selbst-abbauende Kunststoffe hergestellt werden, um nur zwei Beispiele zu nennen.
Um biofunktionalisierte thermoplastische Kunststoffe herzustellen, zu verarbeiten und die erhaltene Aktivität der technischen Enzyme in ihnen nachzuweisen, können handelsübliche Matrixmaterialien wie Polyethylen niedriger Dichte (LDPE), Polybutylensuccinat-co-adipat (PBSA) sowie Polybutylenadipat-co-terephthalat (PBAT) verwendet werden. Es sind damit Vertreter thermoplastischer Kunststoffe, die entweder petrobasiert, vollständig biobasiert oder teilweise biobasiert sind. Sie gehören zu den Polyolefinen und Polyestern und sind in ihrer Zusammensetzung ungefüllte Thermoplaste. Die Verarbeitungstemperaturen der Kunststoffschmelzen der untersuchten und der zusätzlich genannten Materialien liegen im Bereich von 90°C bis 200°C. Der Schmelzeflussindex liegt insbesondere im Bereich von 0,5 bis 40 g/10 min (bei 190 °C/2,16 kg) oder teilweise auch darüber. Damit sind die Kunststofftypen für den Einsatz in der Flach- und Blasfolienextrusion, im Thermoformen, für Strang-, Profil- und Rohrextrusionsverfahren, Blasformen, für Spritzgussverfahren, für Schäumverfahren und für Verfahren der additiven Fertigung abgedeckt.
Als biologischer Funktionsträger werden stabilisierte Enzymformulierungen eingesetzt. Dabei spielt die Enzymklasse keine Rolle und kann nahezu alle bekannten Enzymformulierungen umfassen, wobei bevorzugt auf feste Formulierungen zurückgegriffen wird, um eine einfache Dosierung als Feststoff zu ermöglichen. Beispielhaft wurde eine technische Protease (EC 3.4.21.62), die als Subtilisin bekannt ist, genutzt. Die Protease hat ein pH-Optimum bei 11,0 (50% rel. Aktivität zwischen pH 7,0 und pH 12,0) sowie ein Temperaturoptimum bei 60 °C (50% rel. Aktivität zwischen 45 °C und 65 °C).
Vorprozessierung
Zur Erzeugung von temperaturstabilen Enzymformulierungen werden stabilisierende Zuschlagstoffe verwendet. Besonders hervorzuheben ist hier die Adsorption von Enzymen an anorganischen Trägern mit großer Oberfläche. Die Stabilität des Beispielenzyms Subtilisin wird hauptsächlich durch die Adsorption an Kaolin bedingt. Die Adsorption an anorganische Träger hat vor allem den Vorteil, dass die Trägersubstanzen meist günstig und in großer Menge erhältlich sowie keine Konjugation oder anderweitige Veränderung des Enzyms notwendig sind. Gleichzeitig ist der Einbau von Mineralien ein Standardverfahren bei der Kunststoffprozessierung, da z.B. das Compoundieren von Talk oftmals zur Einrichtung des Extruderbetriebs bzw. zur Optimierung von Additivierungen eingesetzt wird. Neben Kaolinit kommen weitere Träger mit großer Oberfläche als adsorptives stabilisierender Träger für Enzyme in Frage.
Übliche Enzymformulierungen zeigen inhomogene Partikelgrößenverteilungen und z.T. Partikelgrößen im Millimeterbereich. Um eine homogene Verteilung in der Kunststoffschmelze zu erreichen, den Einfluss auf die mechanische Festigkeit des Kunststoffs zu minimieren und um die Verarbeitung zu Blasfolien zu ermöglichen, müssen die festen Enzymformulierungen vorprozessiert werden. Hierzu eignen sich schonende Mahlvorgänge mittels Kugelmühlen unter Kühlung durch Stickstoff oder Trockeneis, sodass eine Zielgröße der Partikel von 10-20 µm erreicht wird. Die erhaltenen Pulver können noch weiter durch Sieben homogenisiert werden. Die so erhaltenen Pulver können im Anschluss als feste Zuschlagstoffe während der Extrusion zudosiert werden. Bei Enzymformulierungen, die bereits fein genug sind, z.B. beim Einsatz von anorganischen Nanostrukturen zur Stabilisierung, kann auf eine Vorprozessierung verzichtet werden und die Formulierung direkt für die Herstellung von Compounds eingesetzt werden.
Herstellung von biofunktionalisierten Compounds
Für die Herstellung der beschriebenen, biofunktionalisierten thermoplastischen Kunststoffe und des technischen Enzyms wurde ein gleichläufiger Doppelschneckenextruder mit Seitenbeschickung verwendet. Der Schneckendurchmesser beträgt 28 mm, die Verfahrenslänge des Extruders 52 L/D. Die Elemente der Extruderschnecke wurden so gewählt, dass nur in äußerst geringem Maße Scherenergie in die Kunststoffschmelze eingebracht wird. Die Anzahl an Knet- und Scherelementen wurden reduziert, Knetelemente mit niedrigen Steigungen verwendet. Über die Seitenbeschickung wurde erst im letzten Drittel der Extruderlänge vor der Düse das Proteasepulver in die Kunststoffschmelze dosiert. Nach Düsenaustritt wurde der extrudierte Kunststoffstrang im Wasserbad gekühlt, über ein Transportband abgezogen, mit Druckluft weiter abgekühlt und getrocknet und in einer Schneidmühle granuliert.
Biofunktionalisierte Kunststoffe, bestehend aus LDPE und 3 Gewichtsprozent technischer Protease, wurden mit einem Extruderdurchsatz von 3 kg pro Stunde hergestellt. In gleicher Verfahrensweise wurden ebenfalls 0,5, 1 und 6 Gewichtsprozent Protease eingesetzt. Die Drehzahl wurde zwischen 75 UpM und 500 UpM variiert, durch Wahl des Temperaturprofils die Massetemperaturen an der Düsenspitze des Extruders zwischen 130 °C und 220 °C. Die Charakterisierung erfolgte anhand der optischen Beschaffenheit, der mechanischen Eigenschaften, der mikroskopischen Verteilung sowie der eigentlichen biologischen Aktivität.
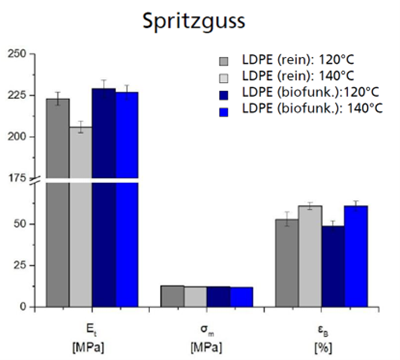
Optisch entsprachen die Compounds weitestgehend dem Standard (Abb. 2). Bedingt durch den Einbau von Partikeln zeigten sich solche verteilt in Compound und Halbzeug. Mit zunehmender Massetemperatur und Schneckendrehzahl wurde eine verstärkte Verfärbung ins Gelbliche festgestellt, was auf ein Verbrennen einzelner Komponenten zurückzuführen ist. Die mechanischen Eigenschaften wurden durch die Additivierung mit Enzym nicht signifikant beeinträchtigt, lediglich leichte Veränderungen in Elastizität und Bruchdehnungskraft waren zu verzeichnen (Abb. 3). Diese Untersuchungen wurden mit Spritzgussprüfkörpern durchgeführt. Mikroskopische Untersuchungen zeigten, dass die Enzympartikel mit einer Größe im Bereich von 10-50 µm sowohl innerhalb als auch an der Oberfläche der Compounds nachzuweisen waren.
Der Nachweis biologisch aktiver Protease mit 3 Gewichtsprozent Anteil an der LDPE-Matrix wurde für folgende Verfahrensbedingungen erbracht: 75 UpM / Massetemperaturen 130°C bis 160°C, 75 UpM bis 300 UpM / Massetemperaturen 130°C bis 140°C (Abb.4).
Die Aktivitätsbestimmung der Compounds erfolgte in einem photometrischen Assay und im Vergleich zwischen ganzen und gemahlenen Compounds. Durch Mahlen der Probe werden zusätzlich die Enzyme freigelegt, die sich innerhalb des Compounds befinden und nicht über die Oberflächen zugänglich sind. Ohne Mahlen werden nur Enzyme an der Oberfläche analysiert. Die gemahlenen Compounds zeigten stets eine deutlich erhöhte Aktivität, was verdeutlicht, dass nicht nur die Enzyme auf der Compoundoberfläche aktiv sind, sondern auch die Enzyme, die vollständig von Kunststoff umschlossen sind. In Untersuchungen zur thermischen Stabilität von Subtilisin und Subtilisin in LDPE zeigte sich, dass die thermische Stabilität durch Einbettung in den Kunststoff signifikant gesteigert werden konnte (40 K). Dies ist wahrscheinlich darauf zurückzuführen, dass der Kunststoff zunächst eine bestimmte Menge der thermischen Energie absorbiert, bevor diese auf das Enzym einwirken kann. Mit zunehmender Schneckendrehzahl während der Extrusion sank die Aktivität signifikant, wobei ein deutlicher Sprung zwischen 200-400 min-1 festgestellt wurde (Abb. 4B). Im Gegensatz zu den gemahlenen Compounds, bei denen die Aktivität im genannten Drehzahlbereich linear abnimmt, tritt bei Untersuchung der Enzyme, die sich nur auf der Oberfläche befinden, der größte Aktivitätsabfall erst zwischen 300 und 400 min-1 ein. Bei der Massetemperatur wird ein ähnlicher Effekt beobachtet: Hier fällt die Aktivität oberhalb einer Verarbeitungstemperatur von 160°C schlagartig ab (Abb. 4A). Die Enzymkonzentrationsvariation zeigt, dass mit zunehmendem Anteil an Enzym die Aktivität auf den Compoundoberflächen ansteigt. Wird jedoch das gemahlene Compound betrachtet, ist ein Maximum der Aktivität bei 1 % (w/w) mit anschließender Reduktion der Aktivität bei 3 und 6 % (w/w) zu verzeichnen. Nach dem Herstellen der Compounds wurden diese für weitere Verarbeitungsschritte zu Halbzeugen und Endprodukten umgesetzt.
Weiterverarbeitung zu Halbzeugen und Endprodukten
Der mittels Compoundierung auf dem Doppelschneckenextruder hergestellte biofunktionalisierte Kunststoff in Form von Granulat wurde in einem zweiten thermoplastischen Verarbeitungsschritt zu Halbzeugen oder Endprodukten weiterverarbeitet. Beispielhaft wird die Blasfolienverarbeitung beschrieben, für die ein Einschneckenextruder mit Schneckendurchmesser 25 mm und Verfahrenslänge von 25 L/D eingesetzt wurde. Die Extrusion der Kunststoffschmelze erfolgte über eine Ringdüse mit 50 mm Durchmesser und 0,8 mm Düsenspaltbreite, gefolgt von Maschineneinheiten zur Folienflachlegung und Wickelung. Bei der Folienherstellung wurden die Massetemperaturen von 126-200°C variiert. Es wurden Blasfolien mit einer Foliendicke von 85 µm hergestellt (Abb. 5). Zur Minimierung der Scherung sowie der thermischen Belastung wurde ebenfalls ein 1-stufiges Verfahren getestet, indem die Compoundierung mit Doppelschneckenextruder direkt in der Blasfolienanlage mündet. Der Nachweis biologisch aktiver Protease mit 3 Gewichtsprozent Anteil an der LDPE-Matrix in der Blasfolie wird für folgende Verfahrensbedingungen erbracht: 30 UpM / Massetemperaturen 126°C bis 166°C (Abb. 6).
Erstaunlicherweise war die Aktivität beim 2-stufigen Prozess deutlich höher als beim 1-stufigen, was auf eine zusätzliche Stabilisierung des Enzyms durch den Einbau in das Polymer hervorgerufen werden könnte. Diese Beobachtung wurde bereits im vorigen Abschnitt beleuchtet. Auch für die Blasfolien zeigte sich, dass die Aktivität oberhalb einer Verarbeitungstemperatur von 160°C schlagartig einbricht (Abb. 6). Ein Anrauen der Folie ergab eine leichte Aktivitätssteigerung, sodass davon ausgegangen werden kann, dass die Proteasepartikel tatsächlich vollständig in LDPE eingebettet sind. Ein Mahlen der Folie, um die Aktivität der im Bulk eingebetteten Protease zu bestimmen, bewirkt eine Aktivitätssteigerung um das 5 bis 6-fache (Abb. 6). Die mikroskopische Untersuchung der Blasfolienoberfläche zeigte deutlich, dass die Partikel sowohl auf der Oberfläche als auch vollständig von Kunststoff umschlossen in der Folie vorlagen, was auch die Erhöhung der Aktivität nach dem Mahlvorgang erklärt (Abb. 7).
Anwendungsfelder und Ausblick
Die Anwendungsfelder der biofunktionalisierten Polymere richten sich nach dem eingebauten Enzym, was einerseits eine breite Palette an möglichen Einsatzgebieten mit sich bringt, andererseits die dedizierte Darstellung von Anwendungsfeldern erschwert. Der Einsatz von Hydrolasen (wie Proteasen und Lipasen) kann zu einem Material mit Selbstreinigungswirkung führen, da diese Enzyme Ablagerungen aus Protein und Fetten abbauen können. Des Weiteren werden verschiedenen speziellen Hydrolasen (Proteasen, Cutinasen u.a.) depolymerisierende Eigenschaften zugeschrieben. Ein bekanntes Beispiel ist hierbei die PETase, die in der Lage ist PET zu depolymerisieren. Die Integration solcher Enzyme würde einen intrinsischen Depolymerisationsmechanismus in den Kunststoff integrieren und so zu beschleunigten oder induziertem Abbau führen. Ein weiteres mögliches Anwendungsfeld ist der Einsatz bei der Prozessierung von Lebensmitteln sowie in der Gestaltung von aktiv haltbarkeitsverlängernden Kunststoffverpackungen.
Es wird noch einige Entwicklungsarbeit in Anspruch nehmen, jedoch ist die Biotransformation der Kunststofftechnik bereits auf vielen Ebenen in vollem Gange und die Additivierung mit funktionalen Biomolekülen ein Baustein dieses weiten Feldes. Das allgemeine Ziel ist es, Kunststoffe nicht nur nachhaltiger und kreislauffähiger, sondern bekannte, etablierte Kunststoffe durch die Integration von biologischen Einheiten smarter und funktionaler werden zu lassen. Dies eröffnet nicht nur neue Anwendungsmöglichkeiten für bekannte Materialien, sondern verdeutlicht auch, dass Kunststoffe und Natur keine Gegensätze sein müssen, sondern innovativ zusammengebracht werden können.
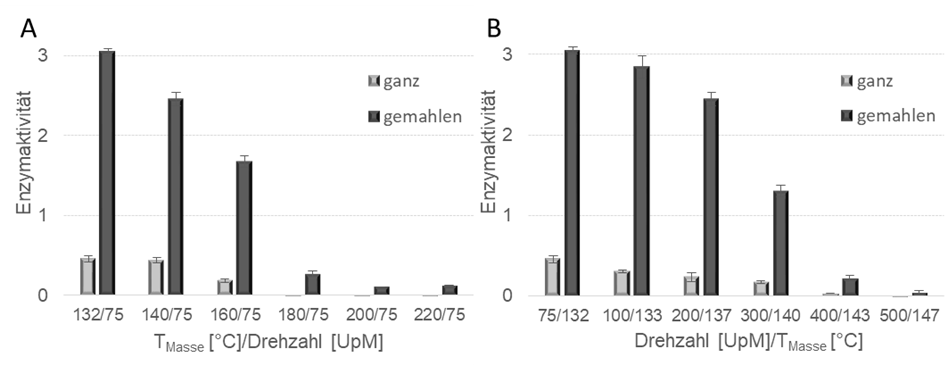
Abb. 4: Enzymaktivitäten der Compounds in Abhängigkeit der Massetemperatur (A) und Schneckendrehzahl (B). Es werden ungemahlene (ganz) und gemahlene Compounds verglichen.
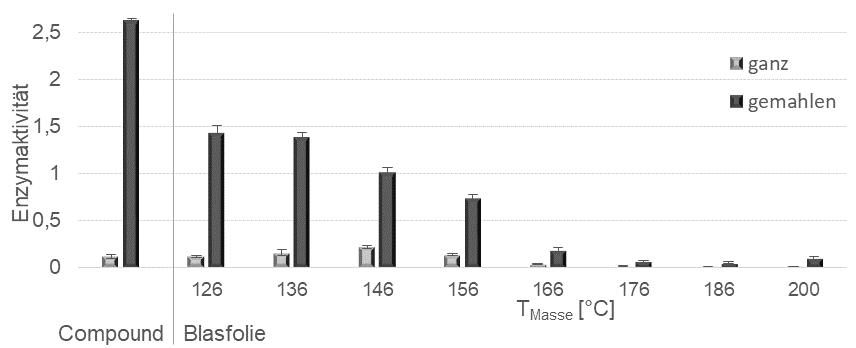
Abb. 6: Enzymaktivitäten des Ausgangscompounds und daraus hergestellter Blasfolien bei unterschiedlichen Massetemperaturen. Es werden ungemahlene (ganz) und gemahlene Compounds bzw. Blasfolien verglichen.
Autoren: Ruben R. Rosencrantz, Sophia Rosencrantz, Karina Wolf, Stefan Böhler, Jens Balko, Thomas Büsse, Johannes Ganster
Redaktion: sbr
Abbildungen: Adobe Stock / Production Perig [1]; Fraunhofer IAP [2-8]